Make You Smarter - Persamaan keadaan (Equation of State) adalah
persamaan yang menghubungkan antara tekanan, suhu dan volum jenis
(spesific volume) dari suatu zat. Pada tulisan sebelum ini, kita telah
melihat bagaimana hubungan dari ketiga properti ini melalui tabel yang
berlaku untuk air.
Ada banyak jenis persamaan keadaan, namun yang paling sederhana diantaranya adalah persamaan gas ideal.
Ada banyak jenis persamaan keadaan, namun yang paling sederhana diantaranya adalah persamaan gas ideal.
R adalah konstanta proporsionalitas yang disebut dengan gas constant memiliki nilai yang berbeda-beda tergantung jenis gas nya.
Persamaan diatas biasa ditulis dengan:
dimana Ru merupakan konstanta gas universal
(universal gas constant) dan M adalah berat molekul. Dan, massa adalah
jumlah molekul di kalikan dengan berat molekul, yakni m = N.M, persamaan keadaan gas ideal dapat ditulis menjadi:
PV = N Ru T
Nilai untuk Universal Gas Constant, Ru dalam berbagai jenis satuan adalah sebagai berikut:
8.314 kJ/(kmol×K)
8.314 kPa×m3/(kmol×K)
1.986 Btu/(lbmol×R)
1545 ft×lbf/(lbmol×R)
10.73 psia×ft3/(lbmol×R)
Jika suatu gas mengalami tekanan
yang jauh lebih rendah dari tekanan kritisnya dan suhu yang jauh lebih
tinggi dari suhu kritisnya maka gas tersebut dapat diperlakukan sebagai
gas ideal.
Jika suatu gas diperlakukan sebagai gas ideal, maka rumusan berikut berlaku pada gas tersebut:
Persamaan keadaan gas ideal sangat
sederhana, namun range penerapannya terbatas, sehingga diperlukan suatu
persamaan keadaan yang akurat pada range yang lebar. Persamaan keadaan
lain yang dikenal antara lain adalah:
- Persamaan Van der Waals (salah satu persamaan keadaan yang terdahulu)
- Persamaan Beattie-Bridgeman (terkenal dan cukup akurat)
- Persamaan Benedict-Webb-Rubin (terbaru dan sangat akurat)
Persamaan Van der Waals:
dimana
Persamaan Benedict-Webb-Rubin




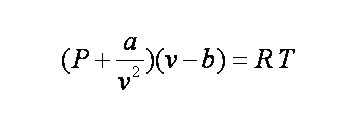











0 coment�rios: