Galvanisasi
Galvanisasi merupakan salah satu cara untuk mengurangi/ menghindari proses korosi dengan melapisi logam yang kita ingin lindungi dengan logam lain yang lebih mudah terkorosi. Ide galvanisasi sendiri berawal dari proses sel galvani dan korosi galvani.
Sel galvani
Sel galvani atau disebut juga sebagai sel volta adalah sel elektrokimia yang dapat menyebabkan terjadinya energi listrik dari reaksi reduksi dan oksidasi (redoks) yang spontan. Reaksi redoks spontan yang dapat mengakibatkan terjadinya energi listrik ini ditemukan oleh Luigi Galvani dan Alessandro Guiseppe volta.
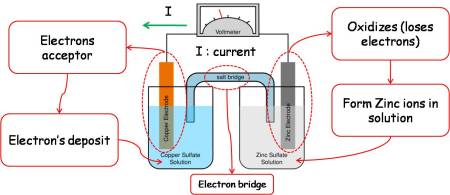
Contoh rangkaian sel galvani.
Sel galvani terdiri dari beberapa bagian, yaitu:
Proses pada sel galvani
Pada anoda, logam Zn melepaskan elektron dan menjadi Zn2+ terlarut.
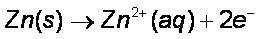
Pada katoda, ion Cu2+ menangkap elektron dan mengendap menjadi logam Cu.

Hal ini dapat diketahui dari berkurangnya massa logam Zn setelah reaksi, sedangkan massa logam Cu bertambah. Reaksi total yang terjadi pada sel galvani adalah:

Galvanic Corrosion
Dalam pencegahan korosi, digunakan juga konsep galvani ini yang disebut dengan Galvanic corrosion. Galvanic corrosion terjadi ketika dua buah logam yang dihubungan secara fisik akan mengalami korosi, namun korosi hanya akan terjadi pada salah satu logam saja. Galvanic corrosion terjadi akibat adanya perbedaan galvani series, hal tersebut mengakibatkan hanya logam yang lebih mudah terkorosi saja yang akan terkorosi. Semakin inert suatu logam maka akan semakin susah terkorosi. Hal tersebut mirip dengan galvani sel dimana salah satu logam (misal Zn pada proses galvani Zn dan Cu) akan berkurang massanya akibat elektron terlepas dari logam tersebut. Salah satu contoh galvani corrosion adalah adalah baja yang dikelilingi oleh magnesium (gambar dibawah). Akibat perbedaan galvani series yang cukup besar, magnesium menjadi terkorosi, sedangkan inti baja tidak terkorosi sama sekali.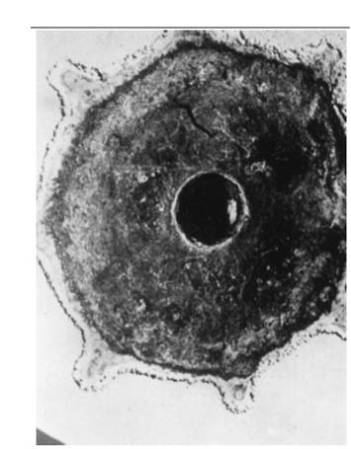
Galvanisasi
Galvanisasi adalah proses pelapisan logam dengan logam lain yang lebih mudah terkorosi, hal tersebut dimaksudkan untuk melindungi logam bagian dalam dari korosi, baik terlindungi secara posisi juga secara kimia. Galvanisasi juga bermaksud untuk membentuk logam yang mudah terkorosi tersebut menjadi ‘anoda korban’, yaitu anoda yang sengaja dikorbankan terkorosi.
Pada umumnya, pelapisan besi atau baja menggunakan zinc atau seng. Hal tersebut dikarenakan zinc lebih cepat terkorosi dibandingkan dengan besi atau baja, zinc juga lebih murah dan mudah ditemukan. Bahan lain yang biasa digunakan sebagai pelapis adalah alumunium.

Salah satu cara galvanisasi adalah dengan Hot-dip Galvanization atau dengan mencelupkan bahan ke dalam logam pelapis cair. Berikut merupakan tahap Hot-dip galvanization :
Membersihkan minyak dan lemak (grease), proses yang pertama kali dilakukan adalah dengan membersihkan permukaan logam yang akan dilapisi. Permukaan tersebut harus dibersihkan agar lapisan dapat melekat pada logam dengan baik. Pada tahap ini permukaan logam yang akan dilapisi dibersihkan dari debu, tanah, minyak dan lemak dengan menggunakan pembersih alkali yang panas.
Pickling, pada tahap ini permukaan dibersihkan dari karat agar logam menjadi lebih murni, dan siap untuk dicelupkan. Tahap ini berlangsung selama 30 sampai 1 ½ jam tergantung dari ketebalan karat tersebut.
Fluxing, ini merupakan tahap terakhir dari pembersihan permukaan logam. Fluxing bermaksud untuk menghilangkan oksida yang ada di permukaan dan oksida yang mungkin terbentuk dengan menggunakan larutan zinc ammonium chloride.
Galvanisasi, tahap ini merupakan tahap pelapisan logam dengan menggunaan zinc. Baja yang akan dilapisi kemudian dicelupkan ke dalam larutan zinc yang bersuhu sekitar 840o F (449o C). ketika baja tersebut dicelupkan maka akan terbentuk lapisan zinc-baja yang tahan terhadap goresan, sedangkan pada bagian paling atas akan dilapisi oleh zinc murni. Zinc yang biasa digunakan adalah zinc dengan kemurnian 98%. Zinc yang berlebih akan dilepaskan dengan cara dialirkan, digetarkan atau disentrifugal. Baja tersebut kemudian didinginkan di air ataupun di udara bebas. Agar baja-zinz tersebut lebih tahan pada berbagai macam cuaca dan kondisi, baja-zinc tersebut kemudian dilapisi atau disemprot dengan cat atau semacamnya.
Pemeriksaan, langkah terakhir adalah pemeriksaan untuk melihat apakah hasil sudah sesuai dengan spesifikasi. Pemeriksaan dilakukan untuk melihat ketebalan zinc, keseragaman (uniformity), kerekatan, dan penampilannya. Standar yang biasa dilakukan adalah ASTM, the Canadian Standards Association (CSA), and the American Association of State Highway and Transportation Officials (AASHTO). Standar-standar tersebut melingkupi semua yang dibutuhkan pada galvanisasi baik dari ketebalannya, keseragamannya, kerekatannya dan penampilannya.

Salah satu tujuan lain digunakannya zinc sebagai pelapis adalah untuk membentuk lapisan tipis zinc carbonate yang rapat, kuat, dan susah dipecahkan untuk menghindari korosi lebih lanjut. Zinc yang dipakai untuk menjadi anoda korban akan terpapar udara karena letaknya yang paling luar, ketika bereaksi dengan oksigen akan membentuk zinc oksida, kemudian akan membentuk zinc hidroksida ketika bereaksi dengan uap air di udara. Ketika zinc hidroksida bereaksi dengan karbon dioksida, maka akan terbentuk zinc karbonat. Zinc karbonat inilah yang kemudian akan menjadi ‘tameng’ korosi.
Galvanisasi merupakan salah satu cara untuk mengurangi/ menghindari proses korosi dengan melapisi logam yang kita ingin lindungi dengan logam lain yang lebih mudah terkorosi. Ide galvanisasi sendiri berawal dari proses sel galvani dan korosi galvani.
Sel galvani
Sel galvani atau disebut juga sebagai sel volta adalah sel elektrokimia yang dapat menyebabkan terjadinya energi listrik dari reaksi reduksi dan oksidasi (redoks) yang spontan. Reaksi redoks spontan yang dapat mengakibatkan terjadinya energi listrik ini ditemukan oleh Luigi Galvani dan Alessandro Guiseppe volta.

Contoh rangkaian sel galvani.
Sel galvani terdiri dari beberapa bagian, yaitu:
- Voltmeter, untuk menentukan besarnya potensial sel.
- Jembatan garam (salt bridge), untuk menjaga kenetralan muatan listrik pada larutan.
- Anoda, elektroda negatif tempat terjadinya reaksi oksidasi.
- Katoda, elektroda positif tempat terjadinya reaksi reduksi .
Proses pada sel galvani
Pada anoda, logam Zn melepaskan elektron dan menjadi Zn2+ terlarut.
Pada katoda, ion Cu2+ menangkap elektron dan mengendap menjadi logam Cu.
Hal ini dapat diketahui dari berkurangnya massa logam Zn setelah reaksi, sedangkan massa logam Cu bertambah. Reaksi total yang terjadi pada sel galvani adalah:
Galvanic Corrosion
Dalam pencegahan korosi, digunakan juga konsep galvani ini yang disebut dengan Galvanic corrosion. Galvanic corrosion terjadi ketika dua buah logam yang dihubungan secara fisik akan mengalami korosi, namun korosi hanya akan terjadi pada salah satu logam saja. Galvanic corrosion terjadi akibat adanya perbedaan galvani series, hal tersebut mengakibatkan hanya logam yang lebih mudah terkorosi saja yang akan terkorosi. Semakin inert suatu logam maka akan semakin susah terkorosi. Hal tersebut mirip dengan galvani sel dimana salah satu logam (misal Zn pada proses galvani Zn dan Cu) akan berkurang massanya akibat elektron terlepas dari logam tersebut. Salah satu contoh galvani corrosion adalah adalah baja yang dikelilingi oleh magnesium (gambar dibawah). Akibat perbedaan galvani series yang cukup besar, magnesium menjadi terkorosi, sedangkan inti baja tidak terkorosi sama sekali.

Galvanisasi
Galvanisasi adalah proses pelapisan logam dengan logam lain yang lebih mudah terkorosi, hal tersebut dimaksudkan untuk melindungi logam bagian dalam dari korosi, baik terlindungi secara posisi juga secara kimia. Galvanisasi juga bermaksud untuk membentuk logam yang mudah terkorosi tersebut menjadi ‘anoda korban’, yaitu anoda yang sengaja dikorbankan terkorosi.
Pada umumnya, pelapisan besi atau baja menggunakan zinc atau seng. Hal tersebut dikarenakan zinc lebih cepat terkorosi dibandingkan dengan besi atau baja, zinc juga lebih murah dan mudah ditemukan. Bahan lain yang biasa digunakan sebagai pelapis adalah alumunium.

Salah satu cara galvanisasi adalah dengan Hot-dip Galvanization atau dengan mencelupkan bahan ke dalam logam pelapis cair. Berikut merupakan tahap Hot-dip galvanization :
Membersihkan minyak dan lemak (grease), proses yang pertama kali dilakukan adalah dengan membersihkan permukaan logam yang akan dilapisi. Permukaan tersebut harus dibersihkan agar lapisan dapat melekat pada logam dengan baik. Pada tahap ini permukaan logam yang akan dilapisi dibersihkan dari debu, tanah, minyak dan lemak dengan menggunakan pembersih alkali yang panas.
Pickling, pada tahap ini permukaan dibersihkan dari karat agar logam menjadi lebih murni, dan siap untuk dicelupkan. Tahap ini berlangsung selama 30 sampai 1 ½ jam tergantung dari ketebalan karat tersebut.
Fluxing, ini merupakan tahap terakhir dari pembersihan permukaan logam. Fluxing bermaksud untuk menghilangkan oksida yang ada di permukaan dan oksida yang mungkin terbentuk dengan menggunakan larutan zinc ammonium chloride.
Galvanisasi, tahap ini merupakan tahap pelapisan logam dengan menggunaan zinc. Baja yang akan dilapisi kemudian dicelupkan ke dalam larutan zinc yang bersuhu sekitar 840o F (449o C). ketika baja tersebut dicelupkan maka akan terbentuk lapisan zinc-baja yang tahan terhadap goresan, sedangkan pada bagian paling atas akan dilapisi oleh zinc murni. Zinc yang biasa digunakan adalah zinc dengan kemurnian 98%. Zinc yang berlebih akan dilepaskan dengan cara dialirkan, digetarkan atau disentrifugal. Baja tersebut kemudian didinginkan di air ataupun di udara bebas. Agar baja-zinz tersebut lebih tahan pada berbagai macam cuaca dan kondisi, baja-zinc tersebut kemudian dilapisi atau disemprot dengan cat atau semacamnya.
Pemeriksaan, langkah terakhir adalah pemeriksaan untuk melihat apakah hasil sudah sesuai dengan spesifikasi. Pemeriksaan dilakukan untuk melihat ketebalan zinc, keseragaman (uniformity), kerekatan, dan penampilannya. Standar yang biasa dilakukan adalah ASTM, the Canadian Standards Association (CSA), and the American Association of State Highway and Transportation Officials (AASHTO). Standar-standar tersebut melingkupi semua yang dibutuhkan pada galvanisasi baik dari ketebalannya, keseragamannya, kerekatannya dan penampilannya.

Salah satu tujuan lain digunakannya zinc sebagai pelapis adalah untuk membentuk lapisan tipis zinc carbonate yang rapat, kuat, dan susah dipecahkan untuk menghindari korosi lebih lanjut. Zinc yang dipakai untuk menjadi anoda korban akan terpapar udara karena letaknya yang paling luar, ketika bereaksi dengan oksigen akan membentuk zinc oksida, kemudian akan membentuk zinc hidroksida ketika bereaksi dengan uap air di udara. Ketika zinc hidroksida bereaksi dengan karbon dioksida, maka akan terbentuk zinc karbonat. Zinc karbonat inilah yang kemudian akan menjadi ‘tameng’ korosi.







0 coment�rios: